
近年來(lái),CAR-T療法在血液瘤治療方面表現出令人(rén)鼓舞的結果,2017年美國FDA批準了兩款CAR-T細胞産品上(shàng)市,極大(dà)地鼓舞了細胞免疫治療研發熱情,CAR-T療法在某些(xiē)血液腫瘤中具有(yǒu)顯著的療效,并預示着腫瘤治療模式的變革。CAR-T細胞療法在其它惡性腫瘤方面也進行(xíng)了深入的研究,部分産品已開(kāi)展了早期臨床試驗,以評估CAR-T細胞的安全性和(hé)有(yǒu)效性。FDA規定CAR-T細胞臨床試驗樣品必須經IND批準在GMP條件下生(shēng)産。
GMP法規見美國Federal Regulations第21篇的各個(gè)章節。它們涵蓋各種産品的制(zhì)造,包括食品、小(xiǎo)分子藥物等。CAR-T最相關的章節在第210和(hé)211部分中介紹,在FDA指南“CGMP for Phase I Investigational Drugs”中簡要介紹了用于早期臨床試驗的生(shēng)産要求。討(tǎo)論的關鍵領域如表1所示,其中包括一個(gè)專門(mén)的章節,涵蓋與細胞和(hé)基因治療産品相關的問題。
表1 FDA關于藥物臨床I期CGMP指南主要內(nèi)容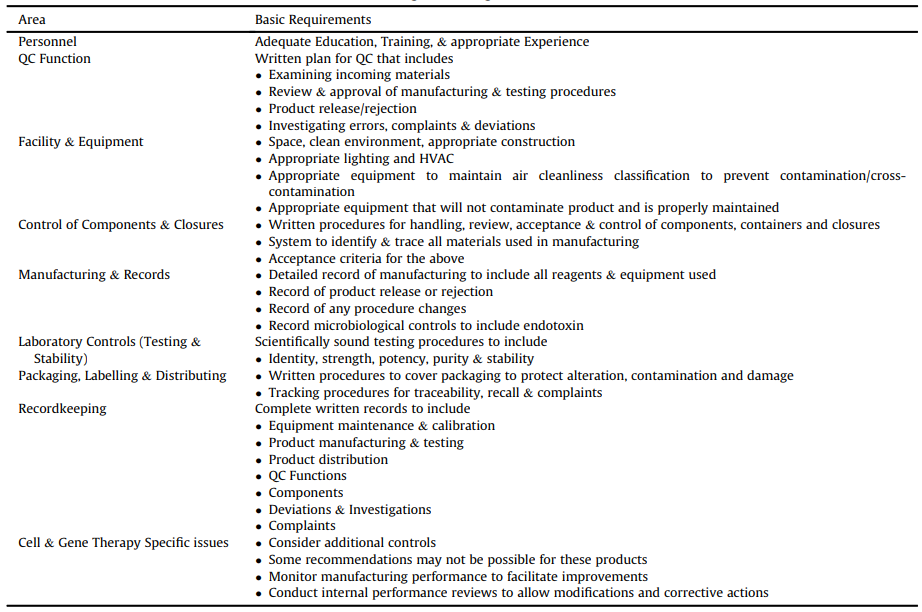
用于制(zhì)造、加工或包裝CAR-T的任何建築或設施應具有(yǒu)适當的尺寸、位置,并采用适當的潔淨室級材料建造,以确保适當的清潔、維護和(hé)生(shēng)産操作(zuò)。制(zhì)造設施中的每個(gè)指定工作(zuò)區(qū)域必須有(yǒu)适當的空(kōng)間(jiān)供設備、材料和(hé)人(rén)員移動,以防止不同部件、過程中材料或不同CAR-T産品之間(jiān)的混合,從而有(yǒu)助于防止污染。如果使用多(duō)産品制(zhì)造設施,則需要進行(xíng)适當的交叉污染研究驗證。
CAR-T細胞治療産品、病毒載體(tǐ)和(hé)質粒的生(shēng)産應當分别在各自獨立的生(shēng)産區(qū)域進行(xíng),并配備獨立的空(kōng)調淨化系統。采用密閉設備、管路進行(xíng)細胞治療産品的生(shēng)産操作(zuò);密閉設備、管路安置環境的潔淨度級别可(kě)适當降低(dī)。同一生(shēng)産區(qū)域有(yǒu)多(duō)條相同的生(shēng)産線,且采用隔離器(qì)的,每個(gè)隔離器(qì)應當單獨直接排風。細胞治療産品、病毒載體(tǐ)、質粒的生(shēng)産操作(zuò)環境的潔淨度級别,可(kě)參照表格中的示例進行(xíng)選擇。
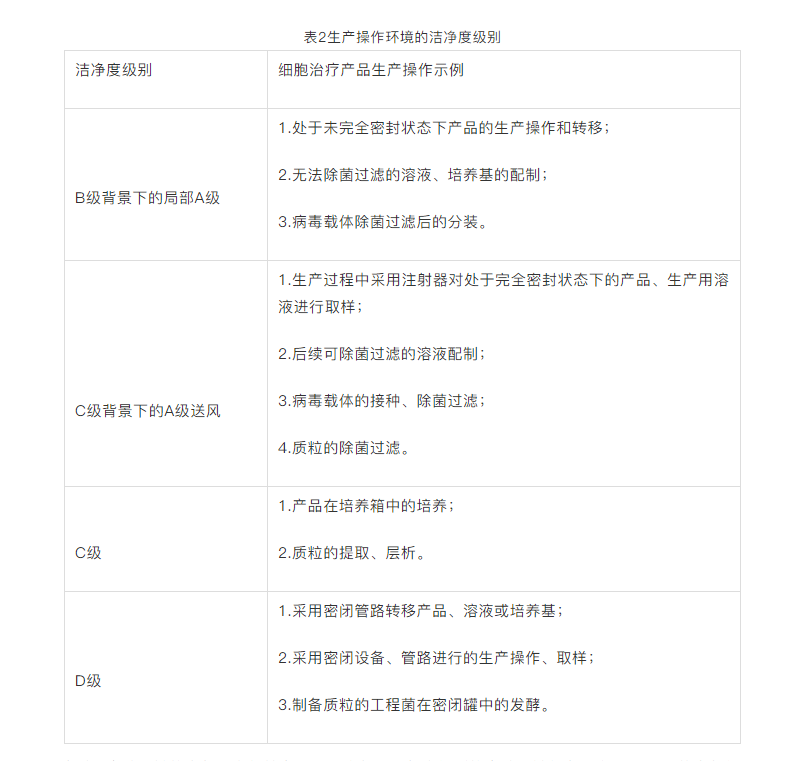
每個(gè)B實驗區(qū)域的空(kōng)氣壓力保持在+50Pa大(dà)氣壓,每個(gè)級别的實驗區(qū)域都有(yǒu)一個(gè)10-15Pa的空(kōng)氣級聯,沒有(yǒu)空(kōng)氣再循環;新鮮空(kōng)氣通(tōng)過終端Hepa過濾器(qì)進入每個(gè)實驗區(qū)域,并通(tōng)過低(dī)水(shuǐ)平抽風器(qì)排出。換氣速率從B實驗區(qū)的70ac/H到D實驗區(qū)的28ac/H不等。每個(gè)II類微生(shēng)物安全櫃和(hé)提供A級環境的QUBE隔離器(qì)都進行(xíng)連續的顆粒監測。每個(gè)實驗室都要與其他實驗室完全隔離,以便用汽化過氧化氫進行(xíng)熏蒸。
目前CAR-T産品常見的生(shēng)産環境有(yǒu)兩種:B+A和(hé)C+A(隔離器(qì)),需要明(míng)确的是,無論是哪種實現形式,按照無菌生(shēng)産要求,所有(yǒu)生(shēng)産環節不能離開(kāi)A級環境,這就要求對無菌生(shēng)産要有(yǒu)充分的理(lǐ)解,否則将面臨合規性方面的挑戰。
B+A是大(dà)家(jiā)首先考慮的生(shēng)産環境實現形式,但(dàn)這種方式面臨一個(gè)問題是不能保證全程在A級環境下完成。C+A是現階段CAR-T産品無菌生(shēng)産的一種理(lǐ)想方案。細胞制(zhì)品生(shēng)産過程中的隔離措施以隔離器(qì)為(wèi)最佳,無菌生(shēng)産的隔離器(qì)對環境的要求可(kě)以降低(dī),而且可(kě)以将離心、培養等關鍵環節集成在隔離器(qì)內(nèi),實現全程的A級隔離。
在這些(xiē)區(qū)域使用的材料和(hé)設備必須盡量減少(shǎo)顆粒物(使用潔淨室級鋼、其他材料等)和(hé)生(shēng)物或化學污染的機會(huì)。應監測周期性好氧和(hé)厭氧微生(shēng)物負荷。
 圖1 GMP廠房(fáng)設計(jì)
圖1 GMP廠房(fáng)設計(jì)
空(kōng)氣處理(lǐ)裝置必須配備适當的設備,并通(tōng)過書(shū)面文件、測試和(hé)定期維護對區(qū)域等級進行(xíng)驗證。不同等級區(qū)域的空(kōng)氣處理(lǐ)裝置應根據其各自的管道(dào)而有(yǒu)所不同。
生(shēng)産區(qū)和(hé)灌裝區(qū)必須明(míng)确劃分和(hé)隔離(必須保持人(rén)員和(hé)物料流動的标準操作(zuò)程序)。必須将适當的顆粒計(jì)數(shù)器(qì)、微生(shēng)物傳感器(qì)、空(kōng)氣流量傳感器(qì)等放置在制(zhì)造設施的工作(zuò)區(qū)域,并保存記錄。
用于生(shēng)産的潔淨室區(qū)域內(nèi)的所有(yǒu)儀器(qì)必須有(yǒu)校(xiào)準标準操作(zuò)規程,并提供定期維護的文件。設施必須定期進行(xíng)空(kōng)氣過濾器(qì)、儀器(qì)等的維護驗證,以确認指定的分類區(qū)域的維護。
工藝标準操作(zuò)規程必須包括安全方法,防止污染,定期測試污染物、微粒和(hé)風險最小(xiǎo)化的方法。生(shēng)産過程中的所有(yǒu)數(shù)據必須在有(yǒu)權限訪問下安全存儲,并在評估過程中提供。
生(shēng)産負責人(rén)應當具有(yǒu)相應的專業知識(如微生(shēng)物學、細胞生(shēng)物學、免疫學等),至少(shǎo)具有(yǒu)三年從事生(shēng)物制(zhì)品或細胞治療産品生(shēng)産或質量管理(lǐ)的實踐經驗。質量負責人(rén)和(hé)質量受權人(rén)應當具有(yǒu)相應的專業知識,至少(shǎo)具有(yǒu)五年生(shēng)物制(zhì)品或細胞治療産品生(shēng)産、質量管理(lǐ)的實踐經驗,從事過生(shēng)物制(zhì)品或細胞治療産品質量保證、質量控制(zhì)等相關工作(zuò)。
從事細胞治療産品生(shēng)産、質量保證、質量控制(zhì)及其他相關人(rén)員(包括清潔、維修人(rén)員)應當經過接受良好的無菌程序、污染物測試、生(shēng)産過程(根據批準的标準操作(zuò)規程)和(hé)維護所有(yǒu)過程相關文件方面的培訓。尤其是預防經供體(tǐ)材料傳播疾病方面的知識,以防止傳染性疾病的病原體(tǐ)在物料、産品和(hé)人(rén)員之間(jiān)傳播以及對環境潛在的影(yǐng)響。
負責制(zhì)造、相關工藝、包裝或搬運的人(rén)員必須在制(zhì)造設施內(nèi)始終穿着幹淨、安全和(hé)适當的衣服,并保持無菌條件(應制(zhì)定人(rén)員進出的标準操作(zuò)規程)。必要時(shí),應穿戴覆蓋身體(tǐ)、頭部、面部、手和(hé)手臂的防護服,以防止産品受到污染(必須制(zhì)定标準操作(zuò)規程)。員工必須養成良好的衛生(shēng)和(hé)健康習慣。從事質粒和(hé)病毒載體(tǐ)制(zhì)備和(hé)細胞治療産品生(shēng)産的人(rén)員不得(de)穿越不同的生(shēng)産區(qū)域。
4.1 生(shēng)産流程
在設計(jì)CAR-T 細胞制(zhì)造SOP時(shí),特别建議開(kāi)發一個(gè)封閉的,或功能封閉的制(zhì)造過程,以降低(dī)産品污染的風險。
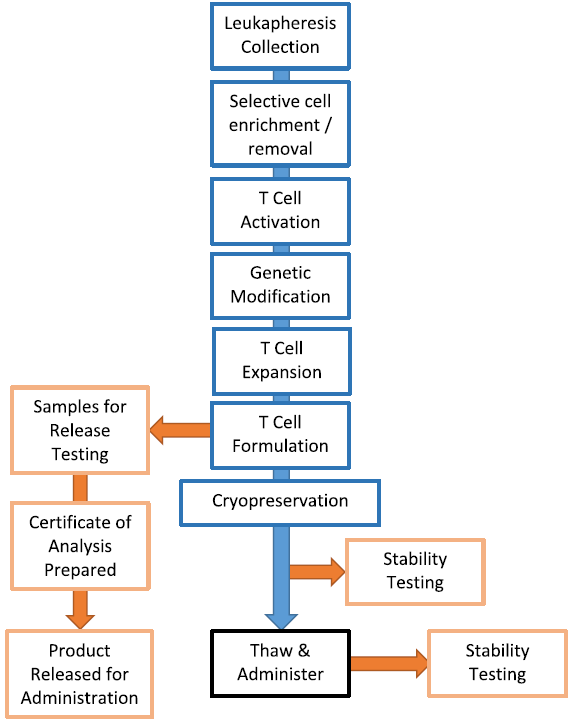 圖2 CAR-T細胞生(shēng)産流程
圖2 CAR-T細胞生(shēng)産流程
從在簡單的T瓶和(hé)細胞培養袋中培養到在複雜的生(shēng)物反應器(qì)中制(zhì)備,理(lǐ)想的系統應該在功能上(shàng)是封閉的,以減少(shǎo)污染的風險,因此,大(dà)多(duō)數(shù)研究人(rén)員已經放棄使用T形瓶。目前,應用最廣泛的培養設備是G-Rex(Wilson Wolf Manufacturing)、Wave biorector(GE Life Systems)和(hé)CliniMACS Prodigy(Miltenyi Biotec)。
G-Rex專為(wèi)懸浮細胞培養設計(jì),氧氣從底部透氣膜滲透進入培養體(tǐ)系,細胞自然沉降至培養瓶底部,葡萄糖等營養物質自然對流至細胞,細胞可(kě)以用GatherRex(Wilson Wolf Manufacturing)收集至轉移包中進行(xíng)下遊處理(lǐ)。
 圖3 符合GMP要求的CAR-T細胞生(shēng)産裝置G-Rex及GatherRex
圖3 符合GMP要求的CAR-T細胞生(shēng)産裝置G-Rex及GatherRex
旭日(Wave)生(shēng)物反應器(qì)是一個(gè)自動化的封閉系統,由一個(gè)放置在搖擺平台上(shàng)的透氣細胞培養袋組成。該系統配備流量控制(zhì)器(qì)、氣體(tǐ)壓力傳感器(qì)、pH、氧氣和(hé)二氧化碳濃度傳感器(qì)等裝置。已經成功地用于生(shēng)産CAR-T,該系統可(kě)用于生(shēng)産1-1000升的産品。
CliniMACS Prodigy全自動多(duō)功能細胞處理(lǐ)系統符合歐盟GMP标準,全封閉操作(zuò)系統,取代傳統方案中多(duō)個(gè)人(rén)工操作(zuò)環節及相應的儀器(qì)設備,輕松實現标準化、全自動CAR-T細胞制(zhì)備過程,包括細胞富集、轉導、洗滌和(hé)擴增,是目前應用最廣泛的自動化設備。在Prodigy裝置中,MACS CD4和(hé)CD8用于細胞富集,CD3/CD28試劑用于激活,慢病毒載體(tǐ)用于細胞轉導,這些(xiē)細胞在TexMACS培養基-3%HS-IL2中培養,洗滌步驟采用PBS/EDTA緩沖液。用Prodigy裝置對起始細胞進行(xíng)洗滌,去除血小(xiǎo)闆,富集CD4+和(hé)CD8+細胞。約10%的CD8+ NK細胞經CD3/CD28活化和(hé)擴增後大(dà)量清除。
4.2 生(shēng)産控制(zhì)
企業應當建立書(shū)面操作(zuò)規程,規定供體(tǐ)材料和(hé)産品在接收、運輸、生(shēng)産、檢驗、放行(xíng)、發放過程中正确标識與核對标識信息的操作(zuò)和(hé)記錄,确保可(kě)識别供體(tǐ)且具有(yǒu)唯一性的編号代碼,不會(huì)發生(shēng)标識錯誤或遺漏,且具有(yǒu)可(kě)追溯性。企業應當制(zhì)定供體(tǐ)篩查标準,制(zhì)訂供體(tǐ)材料采集、運輸、接收标準操作(zuò)規程,詳細說明(míng)供體(tǐ)材料的采集方法、保存和(hé)運輸條件以及接收的标準。
産品生(shēng)産過程中應當采取措施盡可(kě)能防止污染和(hé)交叉污染,如:采用含有(yǒu)傳染性疾病病原體(tǐ)的自體(tǐ)供體(tǐ)材料進行(xíng)生(shēng)産的,其生(shēng)産、轉運過程中不得(de)接觸其它不含有(yǒu)傳染性疾病病原體(tǐ)的供體(tǐ)材料或産品;未采用密閉設備、管路生(shēng)産的,不得(de)在同一區(qū)域內(nèi)同時(shí)進行(xíng)多(duō)個(gè)産品或多(duō)個(gè)批次的生(shēng)産操作(zuò),但(dàn)産品已密封的培養操作(zuò)除外;采用密閉設備、管路在多(duō)條生(shēng)産線上(shàng)同時(shí)生(shēng)産同一品種的多(duō)個(gè)批次時(shí),應當采取有(yǒu)效措施規範人(rén)員、物料和(hé)廢棄物的流向;在密閉條件下進行(xíng)細胞