
近年來(lái),CAR-T細胞因高(gāo)度的特異性以及強大(dà)的抗腫瘤免疫功能被廣泛應用于各種惡性腫瘤的實驗研究和(hé)臨床治療,尤其是在血液系統腫瘤領域取得(de)很(hěn)好的療效。當然,CAR-T細胞不僅僅在血液系統腫瘤領域取得(de)了較大(dà)突破,在實體(tǐ)腫瘤中同樣被認為(wèi)最有(yǒu)前景的腫瘤治療方式之一。
那(nà)麽,2020年,CAR-T細胞領域擁有(yǒu)諸多(duō)突破性進展,本文梅斯醫(yī)學選取一些(xiē)重磅級研究,帶您一起回顧一下CAR-T細胞領域最有(yǒu)價值的研究進展。
免疫治療在腫瘤治療領域發揮重要作(zuò)用,且不斷取得(de)新進展,尤以針對T細胞活化抑制(zhì)性通(tōng)路的單克隆抗體(tǐ)(也被稱為(wèi)免疫檢查點抑制(zhì)劑) 和(hé)嵌合抗原受體(tǐ)T細胞(CAR-T細胞)治療最具代表性。目前,CAR-T細胞治療在血液系統惡性腫瘤中取得(de)了較好的結果,但(dàn)同時(shí)也面臨着很(hěn)多(duō)亟待解決的問題。
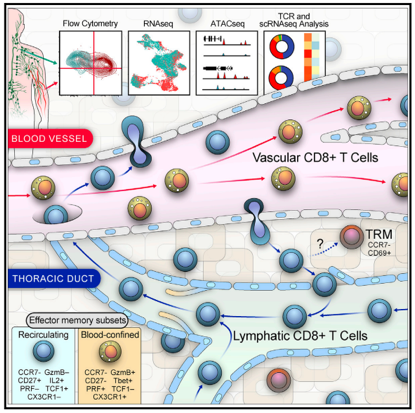
殺傷性T細胞一直被認為(wèi)是免疫系統的主力軍。每個(gè)殺傷性T細胞都攜帶像抗體(tǐ)受體(tǐ)一樣的受體(tǐ),可(kě)以識别特定的靶标。科學家(jiā)們一直認為(wèi),殺傷性T細胞或多(duō)或少(shǎo)地從血液中循環到組織中,然後再循環到血液中,随時(shí)摧毀被識别的靶标。然而,12月10日,來(lái)自美國賓夕法尼亞大(dà)學佩雷爾曼醫(yī)學院的研究人(rén)員分析了人(rén)體(tǐ)和(hé)猕猴的血液和(hé)淋巴液樣本發現,殺傷性T細胞通(tōng)常會(huì)留在血液中,不會(huì)進入器(qì)官和(hé)其他組織,而且淋巴液中存在的CD8 T細胞,通(tōng)常是血液以外的器(qì)官和(hé)其他組織中遷移的CD8 T細胞,而不是血液中大(dà)量存在的經典殺傷性T細胞。這一發現可(kě)能有(yǒu)助于解決免疫學中的許多(duō)難題。
 Cell 2020. doi:10.1016/j.cell.2020.11.019
Cell 2020. doi:10.1016/j.cell.2020.11.019
研究人(rén)員表示,這一發現擴展了人(rén)們對免疫細胞功能的深層理(lǐ)解,對基礎免疫學的影(yǐng)響重大(dà)。同時(shí),這些(xiē)發現可(kě)能會(huì)為(wèi)CAR-T細胞的研究設計(jì)、基因編碼和(hé)細胞生(shēng)産等帶來(lái)更加成熟、安全和(hé)有(yǒu)效的細胞治療技(jì)術(shù)。
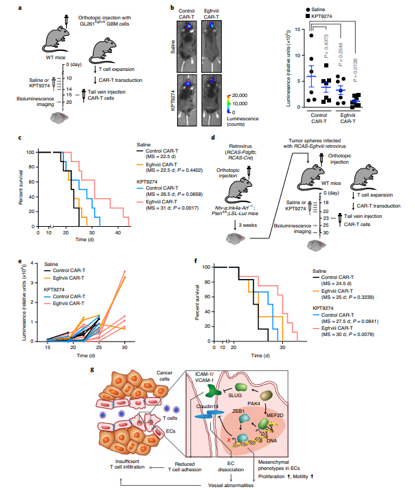
與血液腫瘤不同,實體(tǐ)腫瘤微環境錯綜複雜,在微環境中,存在大(dà)量的纖維基質和(hé)免疫抑制(zhì)細胞,而且往往伴随血管畸形和(hé)纖維結締組織增生(shēng)。來(lái)自賓夕法尼亞大(dà)學佩雷爾曼醫(yī)學院等機構的研究人(rén)員研究發現,将CAR-T療法與PAK4抑制(zhì)劑藥物相結合能促進工程化細胞攻擊腫瘤。
 PAK4抑制(zhì)使GBM對CAR-T免疫療法産生(shēng)敏感性.Nature Cancer. doi:10.1038/s43018-020-00147-8
PAK4抑制(zhì)使GBM對CAR-T免疫療法産生(shēng)敏感性.Nature Cancer. doi:10.1038/s43018-020-00147-8
在這項研究中,研究人(rén)員通(tōng)過對膠質母細胞瘤小(xiǎo)鼠模型進行(xíng)分析發現,抑制(zhì)PAK4或能降低(dī)血管的異常,從而改善T細胞的浸潤并抑制(zhì)小(xiǎo)鼠腫瘤的生(shēng)長,大(dà)約80%PAK4被敲除的小(xiǎo)鼠存活了至少(shǎo)60天,而所有(yǒu)野生(shēng)型小(xiǎo)鼠在腫瘤植入後的40天內(nèi)發生(shēng)了死亡。另外,利用EGFRvIII導向的CAR-T細胞療法和(hé)PAK4抑制(zhì)劑進行(xíng)的研究中,研究者發現,相比輸注5天後僅接受CAR-T細胞治療的小(xiǎo)鼠相比,聯合治療的小(xiǎo)鼠機體(tǐ)中腫瘤的生(shēng)長減少(shǎo)了近80%,而值得(de)注意的是,即使其它組的小(xiǎo)鼠在腫瘤植入後33天內(nèi)發生(shēng)了死亡,聯合治療組中仍然有(yǒu)40%的小(xiǎo)鼠存活了下來(lái)。
這項研究結果與之前研究結論不謀而合,通(tōng)過抑制(zhì)PAK4所實現的血管标準化或能改善藥物的運輸,并降低(dī)腫瘤的缺氧狀況,從而就能改善腫瘤對靶向性療法、放療和(hé)化療的反應率。同時(shí),這項研究進一步揭示了通(tōng)過PAK3抑制(zhì)劑來(lái)重編程整個(gè)血管微環境從而促進并改善癌症的細胞治療。
研究人(rén)員表示,這種療法或許并不僅僅局限于腦(nǎo)瘤,由于血管異常幾乎是每一種實體(tǐ)瘤的常見共同特征,因此其還(hái)能被用于治療諸如乳腺癌、胰腺癌等其它類型的癌症。
過繼性T細胞療法得(de)以改善實體(tǐ)瘤的治療,但(dàn)仍面臨嚴重不良反應及系統性毒性等局限,來(lái)自中國藥科大(dà)學藥物科學研究院張燦教授團隊研發出一種更為(wèi)安全有(yǒu)效的改善T細胞活力的策略。
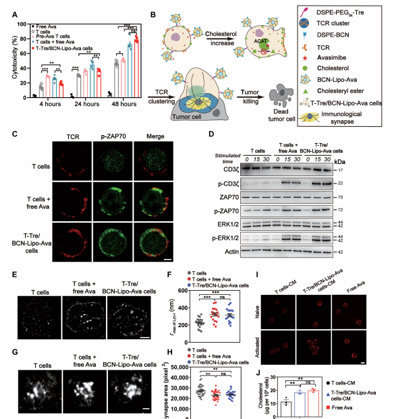
研究團隊建立了新型的T細胞表面錨定技(jì)術(shù),通(tōng)過模拟跨膜蛋白的特性,利用疏水(shuǐ)作(zuò)用力先将脂質錨定在T細胞膜上(shàng),再将脂質與藥物脂質體(tǐ)通(tōng)過點擊反應偶聯在T細胞膜上(shàng)。
 T-Tre/BCN-Lipo-Ava細胞顯示出增強的TCR集群和(hé)免疫學突觸的形成,抗腫瘤反應得(de)到改善.Science Translational Medicine, 12(571), eaaz6667. doi:10.1126/scitranslmed.aaz6667
T-Tre/BCN-Lipo-Ava細胞顯示出增強的TCR集群和(hé)免疫學突觸的形成,抗腫瘤反應得(de)到改善.Science Translational Medicine, 12(571), eaaz6667. doi:10.1126/scitranslmed.aaz6667
研究人(rén)員将阿伐麥布(Avasimibe)與過繼T細胞用于實體(tǐ)瘤聯合治療,結果發現,新型鼠源工程化TCR-T和(hé)人(rén)源工程化CAR-T分别在原位黑(hēi)色素瘤、肺轉移黑(hēi)色素瘤及原位膠質母細胞瘤小(xiǎo)鼠模型中展示出優異的治療效果。其中,工程化CAR-T細胞在原位膠質母細胞瘤小(xiǎo)鼠模型中的完全緩解率達到60%,且生(shēng)存期延長至100天以上(shàng)。并且這種聯用策略具有(yǒu)較好的體(tǐ)內(nèi)安全性。
研究者認為(wèi),工程化T細胞的給藥沒有(yǒu)産生(shēng)明(míng)顯的全身副作(zuò)用,這些(xiē)細胞表面錨定的工程T細胞由于其簡單的生(shēng)成和(hé)安全性,具有(yǒu)較高(gāo)的轉化潛力,也為(wèi)細胞工程化改造提供了新技(jì)術(shù)。
肝癌是全球最常見的癌症緻死原因之一,中國作(zuò)為(wèi)肝癌大(dà)國,整體(tǐ)上(shàng)仍缺乏完善的篩查和(hé)規範的治療體(tǐ)系,據數(shù)據顯示,5年生(shēng)存率目前隻有(yǒu)約12%。目前,肝癌的主要治療手段包括手術(shù)切除、放射和(hé)介入治療,而這些(xiē)治療方式對機體(tǐ)副作(zuò)用較大(dà)、療效不确定,因而急需尋找新的有(yǒu)效的肝癌治療策略。
來(lái)自中國上(shàng)海交通(tōng)大(dà)學醫(yī)學院的研究人(rén)員首次報告了靶向磷脂酰肌醇蛋白聚糖3(GPC3)的CAR-T(CAR-GPC3 T)細胞療法治療肝細胞癌結果。
在這項研究中,研究人(rén)員對患有(yǒu)晚期GPC3+HCC(Child-Pugh A)的成年患者在環磷酰胺(cyclophosphamide)和(hé)氟達拉濱(fludarabine)誘導的淋巴細胞清除後,接受自體(tǐ)CAR-GPC3 T細胞治療,并評估這種療法的有(yǒu)效性和(hé)安全性。
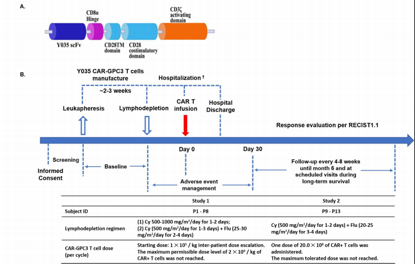 CAR-GPC3 T構建和(hé)研究設計(jì)示意圖.Clin Cancer Res 2020; DOI: 10.1158/1078-0432.CCR-19-3259
CAR-GPC3 T構建和(hé)研究設計(jì)示意圖.Clin Cancer Res 2020; DOI: 10.1158/1078-0432.CCR-19-3259
研究人(rén)員收納了13名符合條件的患者,并給予中位數(shù)19.9×108個(gè)CAR-GPC3 T細胞治療。結果發現,8名患者的CRS(1/2級)是可(kě)逆的。1例患者出現5級CRS。患者沒有(yǒu)出現3~4級神經毒性。随訪3年,1年和(hé)6個(gè)月的總生(shēng)存率分别為(wèi)10.5%、42.0%和(hé)50.3%。此外,研究人(rén)員證實有(yǒu)2名患者出現部分緩解,其中,1名患者病情穩定,在治療44.2個(gè)月後仍然存活。CAR-GPC3 T細胞增殖與腫瘤反應呈正相關。
總體(tǐ)來(lái)說,本研究初步揭示了CAR-GPC3 T細胞療法的安全性,且CAR-GPC3 T細胞在晚期肝細胞癌患者中具有(yǒu)抗腫瘤活性的早期迹象。
CAR-T療法的方法已經成功地用于治療淋巴瘤和(hé)白血病等血癌患者,CAR-T治療通(tōng)過添加能識别癌細胞表面獨特特征的抗體(tǐ)片段來(lái)對患者自身的T細胞進行(xíng)基因改造。在一項新的研究中,來(lái)自美國伊利諾伊大(dà)學厄本那(nà)香槟分校(xiào)、芝加哥(gē)大(dà)學和(hé)丹麥哥(gē)本哈根大(dà)學的研究人(rén)員拓寬了潛在的具有(yǒu)短(duǎn)糖鏈連接的蛋白質靶标,通(tōng)過基因改造的T細胞,對來(lái)自人(rén)類和(hé)小(xiǎo)鼠的各種實體(tǐ)瘤癌細胞進行(xíng)攻擊。
在某些(xiē)癌細胞上(shàng)異常短(duǎn)的糖鏈是由突變導緻的,這些(xiē)突變破壞了這些(xiē)糖與蛋白質連接的分子途徑。研究人(rén)員從已知抗體(tǐ)與特定類型的異常糖相互作(zuò)用開(kāi)始,該糖與小(xiǎo)鼠實體(tǐ)瘤癌細胞上(shàng)的蛋白質相連。緊接着,研究人(rén)員測試了異常糖附近氨基酸序列的變化,以判斷是否會(huì)影(yǐng)響受體(tǐ)與該位點的結合。
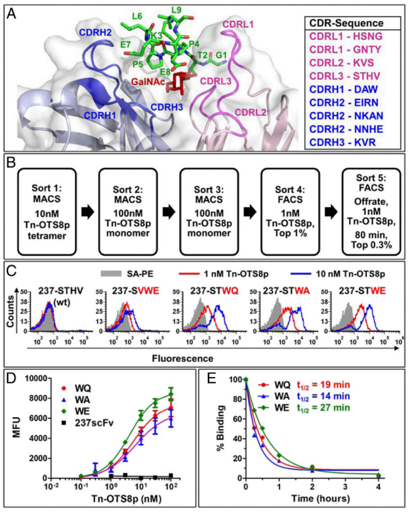 237-scFv與Tn-OTS8肽的親和(hé)力更高(gāo).PNAS, 2020, doi:10.1073/pnas.1920662117.
237-scFv與Tn-OTS8肽的親和(hé)力更高(gāo).PNAS, 2020, doi:10.1073/pnas.1920662117.
結果顯示,Tn-聚糖側翼的殘基(Tn-OTS8)為(wèi)相互作(zuò)用提供了顯着的結合能。用非同源人(rén)類抗原Tn-MUC1進行(xíng)選擇,可(kě)産生(shēng)與多(duō)種Tn-糖蛋白廣泛反應的scFv變異體(tǐ)。當配置為(wèi)CAR時(shí),表達這些(xiē)scFv變體(tǐ)的工程T細胞表現出對O型糖基化缺陷的小(xiǎo)鼠和(hé)人(rén)類癌細胞系改善的活性。T細胞現在可(kě)以識别帶有(yǒu)短(duǎn)糖的幾種不同蛋白質,與這些(xiē)異常的糖鏈結合的藥物可(kě)以優先識别癌細胞。
研究人(rén)員表示,癌細胞在其表面表達某些(xiē)蛋白,這些(xiē)蛋白是由于不同種類的突變而産生(shēng)的。盡管這些(xiē)工程化細胞尚處于早期開(kāi)發階段,但(dàn)可(kě)以使用相同的T細胞産品來(lái)研究抗小(xiǎo)鼠和(hé)人(rén)類癌症的功效和(hé)安全性。
發表在Science雜志(zhì)上(shàng)一項研究,公布了對3名患者進行(xíng)基因編輯CAR-T治療的I期臨床試驗結果。該研究首次證實了CRISPR / Cas9技(jì)術(shù)能夠同時(shí)靶向人(rén)類多(duō)個(gè)基因的能力。經過CRISPR / Cas9基因編輯的CAR-T細胞可(kě)以在癌症患者體(tǐ)內(nèi)持續存在幾個(gè)月的時(shí)間(jiān),并且能夠穩定增殖并發揮功能。
在傳統的CAR T細胞療法中,患者的免疫細胞經過遺傳改造用來(lái)對抗癌症。而本次試驗的方法有(yǒu)所差異。研究人(rén)員并沒有(yǒu)給予T細胞轉入任何靶向癌細胞抗原的CAR受體(tǐ)分子,而是首先使用CRISPR / Cas9編輯去除了3個(gè)關鍵基因。其中2個(gè)基因表達T細胞的天然受體(tǐ),即TCRa與TCRb基因,第三個(gè)基因則表達PD-1,後者被認為(wèi)是調控T細胞活性的關鍵“檢查點”分子。
 CRISPR-Cas9工程T細胞在患者體(tǐ)內(nèi)的持續擴增和(hé)持久性.Science.DOI: 10.1126/science.aba7365
CRISPR-Cas9工程T細胞在患者體(tǐ)內(nèi)的持續擴增和(hé)持久性.Science.DOI: 10.1126/science.aba7365
研究結果發現,相比原始的CAR-T細胞在體(tǐ)內(nèi)不到一周的生(shēng)存期,編輯後的細胞可(kě)在體(tǐ)內(nèi)持續存在長達9個(gè)月的時(shí)間(jiān)。在回輸患者體(tǐ)內(nèi)幾個(gè)月後,研究人(rén)員抽取了更多(duō)血液,并分離了CRISPR編輯的細胞進行(xíng)研究。結果表明(míng),這些(xiē)細胞仍然具有(yǒu)殺死腫瘤的能力。
研究人(rén)員表示,以前的研究表明(míng)這些(xiē)細胞在幾天之內(nèi)就會(huì)失去功能,因此,這項研究中的CRISPR編輯細胞在單次輸注後可(kě)以在更長的時(shí)間(jiān)內(nèi)保持抗腫瘤功能,這一事實令人(rén)鼓舞。
CD19 CAR-T細胞療法已被美國食品藥品管理(lǐ)局(FDA)批準用于治療某些(xiē)類型的血液癌症,即B細胞淋巴瘤和(hé)急性淋巴細胞白血病。來(lái)自美國希望之城的研究人(rén)員将2種強效的免疫療法---溶瘤病毒(oncolytic virus)和(hé)嵌合抗原受體(tǐ)(CAR)T細胞(CAR-T)療法結合起來(lái),成功地靶向和(hé)根除單獨用CAR-T細胞療法很(hěn)難治療的實體(tǐ)瘤
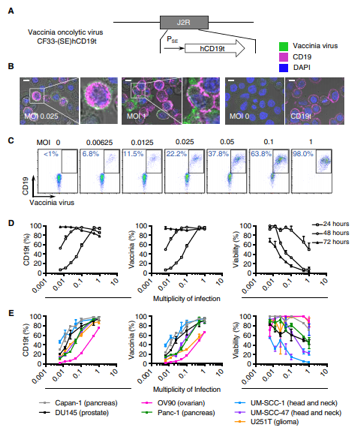 在體(tǐ)外,腫瘤分解病毒(OV)有(yǒu)效地将CD1t遞送至實體(tǐ)瘤.Sci Transl Med. 2020 Sep 2;12(559):eaaz1863. doi: 10.1126/scitranslmed.aaz1863.
在體(tǐ)外,腫瘤分解病毒(OV)有(yǒu)效地将CD1t遞送至實體(tǐ)瘤.Sci Transl Med. 2020 Sep 2;12(559):eaaz1863. doi: 10.1126/scitranslmed.aaz1863.
這項新的研究可(kě)能會(huì)擴大(dà)CD19 CAR-T細胞的使用範圍,用于治療可(kě)能患有(yǒu)任何實體(tǐ)瘤的患者。在這項研究中,研究人(rén)員通(tōng)過對溶瘤病毒進行(xíng)基因改造,使之進入腫瘤細胞,并誘導它們在腫瘤細胞表面上(shàng)表達CD19蛋白。然後,使用靶向CD19的CAR-T細胞來(lái)識别和(hé)攻擊這些(xiē)實體(tǐ)瘤。
研究分析表明(míng),CD19-CAR T細胞介導的腫瘤殺傷還(hái)誘導了垂死的腫瘤細胞釋放病毒,從而傳播了CD19t的腫瘤表達。而且,用溶瘤病毒和(hé)CAR T細胞組合治愈的癌症小(xiǎo)鼠表現出保護性抗腫瘤免疫力的延長。這說明(míng),免疫系統建立了對腫瘤的記憶反應。
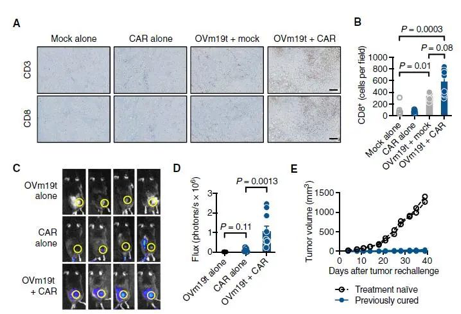 OVm19t促進內(nèi)源性T細胞和(hé)過繼轉移的mCD19- CAR T細胞的腫瘤浸潤.
OVm19t促進內(nèi)源性T細胞和(hé)過繼轉移的mCD19- CAR T細胞的腫瘤浸潤.
目前,研究人(rén)員正在設計(jì)一項臨床試驗,以對患者進行(xíng)這種組合測試。該試驗将首先測試OV19t在實體(tǐ)瘤患者中的安全性,如果發現這是安全有(yǒu)效的,則可(kě)以依次檢測溶瘤病毒和(hé)CAR T細胞療法。研究人(rén)員稱,溶瘤病毒是一種強大(dà)而有(yǒu)前途的方法,可(kě)以與CAR-T細胞療法戰略性地結合起來(lái),以便更有(yǒu)效地靶向實體(tǐ)瘤。
發表在Nat Med雜志(zhì)的一項研究,研究人(rén)員描述了一種新型雙CAR-T(Dual CAR T cell, Dual-CAR-T)細胞免疫療法可(kě)以幫助對抗HIV感染。作(zuò)為(wèi)一種新型的CAR-T細胞,這種Dual-CAR-T細胞是通(tōng)過對T細胞進行(xíng)基因改造使得(de)同一個(gè)T細胞表達兩種CAR。每種CAR都攜帶一個(gè)CD4蛋白,使得(de)它能夠靶向HIV感染細胞,而且每種CAR還(hái)有(yǒu)一個(gè)共刺激結構域,用于向CAR-T細胞發出信号,增加這些(xiē)T細胞的免疫功能。第一種CAR含有(yǒu)4-1BB共刺激結構域,可(kě)刺激細胞增殖和(hé)持久性,而第二種CAR具有(yǒu)CD28共刺激結構域,可(kě)增加這些(xiē)T細胞殺傷HIV感染細胞的能力。
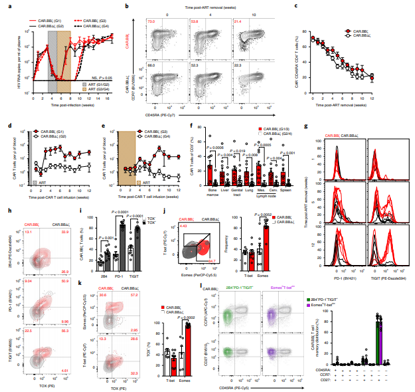 T細胞在無法控制(zhì)病毒反彈後,表現出T細胞衰竭的特征.Nature Medicine. doi:10.1038/s41591-020-1039-5
T細胞在無法控制(zhì)病毒反彈後,表現出T細胞衰竭的特征.Nature Medicine. doi:10.1038/s41591-020-1039-5
由于HIV經常感染T細胞,還(hái)添加了一種叫做(zuò)C34-CXCR4的蛋白,這種蛋白可(kě)防止HIV附着在T細胞上(shàng),因而也就阻止這種病毒感染它們。最終産生(shēng)的Dual-CAR-T細胞壽命長,在應對HIV感染時(shí)進行(xíng)複制(zhì),有(yǒu)效殺滅被感染的細胞,并對HIV感染形成部分抵抗力。
當将受保護的Dual-CAR-T細胞給送到HIV感染的小(xiǎo)鼠體(tǐ)內(nèi)時(shí),這些(xiē)研究人(rén)員觀察到HIV複制(zhì)速度變得(de)較慢,而且相比于未給送Dual-CAR-T細胞的小(xiǎo)鼠,它們具有(yǒu)更少(shǎo)的HIV感染細胞。研究人(rén)員,觀察到這些(xiē)小(xiǎo)鼠血液中的HIV病毒數(shù)量減少(shǎo),CD4+T細胞得(de)以保存下來(lái)。此外,當在HIV感染的小(xiǎo)鼠中組合使用Dual-CAR-細胞細胞和(hé)ART時(shí),這種病毒被更快地抑制(zhì),這就導緻HIV病毒庫比僅接受ART治療的小(xiǎo)鼠更小(xiǎo)。
衰老是細胞老化的一個(gè)标志(zhì),并導緻許多(duō)疾病。一種使免疫細胞靶向衰老細胞的新方法可(kě)能提供更好的治療選擇。衰老是細胞應激反應的一種形式。在某些(xiē)情況下,它可(kě)能是有(yǒu)害的,人(rén)們正在努力開(kāi)發針對衰老細胞的療法。
研究人(rén)員,采用了一種目前用于抗癌治療的技(jì)術(shù)。在這種療法中,T細胞從個(gè)體(tǐ)中移除,在回輸之前,對其進行(xíng)操作(zuò),以增強其針對癌細胞的能力。這種細胞被稱為(wèi)CAR T細胞,因為(wèi)它們被設計(jì)成表達所謂的嵌合抗原受體(tǐ)(CAR)。CAR的設計(jì)目的是識别并結合存在于癌細胞表面的 一種稱為(wèi)抗原的蛋白質的特定片段。如果這種相互作(zuò)用發生(shēng),T細胞就會(huì)被激活并殺死腫瘤細胞。識别隻在腫瘤細胞上(shàng)表達的抗原是一個(gè)關鍵的挑戰,因為(wèi)CAR T細胞殺死健康細胞可(kě)能導緻嚴重的副作(zuò)用。
為(wèi)了找到針對衰老細胞的抗原,研究人(rén)員分析了衰老的人(rén)和(hé)小(xiǎo)鼠細胞中發現的跨膜蛋白的表達。對先前發表的關于人(rén)類組織中蛋白和(hé)RNA表達的數(shù)據進行(xíng)的檢查顯示,uPAR要麽未被檢測到,要麽,在人(rén)體(tǐ)的大(dà)部分器(qì)官(包括中樞神經系統、心髒和(hé)肝髒)中以低(dī)水(shuǐ)平存在。然而,研究人(rén)員發現uPAR在體(tǐ)內(nèi)和(hé)體(tǐ)外衰老細胞中都有(yǒu)高(gāo)表達。有(yǒu)趣的是,缺乏跨膜區(qū)域的一種可(kě)溶性uPAR (suPAR)是SASP反應期間(jiān)分泌的一種成分。suPAR的存在是一些(xiē)慢性疾病的标志(zhì),包括糖尿病和(hé)腎病 ,衰老在這些(xiē)疾病中起作(zuò)用。
 uPAR是一種細胞表面和(hé)分泌的衰老生(shēng)物标志(zhì)物.2020 Nature https://doi.org/10.1038/s41586-020-2403-9
uPAR是一種細胞表面和(hé)分泌的衰老生(shēng)物标志(zhì)物.2020 Nature https://doi.org/10.1038/s41586-020-2403-9
在确定uPAR作(zuò)為(wèi)衰老細胞的普遍标志(zhì)後,研究人(rén)員設計(jì)了靶向uPAR的CAR T細胞。鑒于癌變前的細胞(那(nà)些(xiē)可(kě)能在成為(wèi)癌細胞)出現衰老以及很(hěn)多(duō)抗癌治療導緻腫瘤細胞進入衰老來(lái)阻止他們的分裂,研究人(rén)員調查了這些(xiē)CAR T細胞是否可(kě)以有(yǒu)效治療癌症。
研究結果顯示,以 uPAR為(wèi)靶點的CAR T細胞治療可(kě)以消除小(xiǎo)鼠肝癌和(hé)肺癌模型中衰老的前惡性和(hé)惡性細胞。已經有(yǒu)人(rén)提出,通(tōng)過後續針對衰老細胞的治療,抗癌療法可(kě)能會(huì)得(de)到改善。研究人(rén)員在小(xiǎo)鼠身上(shàng)的研究證實了這種使用具有(yǒu)senolytic CAR T細胞的方法提高(gāo)了抗癌治療的有(yǒu)效 性。
使用senolytic CAR - T細胞的部分吸引力在于其治療衰老涉及的許多(duō)疾病的潛力。事實上(shàng),該研究證明(míng),如果小(xiǎo)鼠接受senolytic CAR T細胞治療,可(kě)以改善非酒精性脂肪性肝炎(一種嚴重的脂肪肝)動物模型的肝纖維化結果。
8月18日,中國科學院分子細胞科學卓越創新中心(生(shēng)物化學與細胞生(shēng)物學研究所)許琛琦研究組與上(shàng)海科技(jì)大(dà)學王皞鵬課題組以及複旦大(dà)學附屬眼耳鼻喉科醫(yī)院吳海濤課題組在國際學術(shù)期刊Immunity上(shàng)以封面文章的形式發表了一項研究,提出了一種新型的“可(kě)循環CAR”設計(jì)方案,顯著提高(gāo)了CAR-T細胞在體(tǐ)內(nèi)的持續活性和(hé)抗腫瘤效果,為(wèi)防止CAR-T治療後的腫瘤複發提供了新策略。
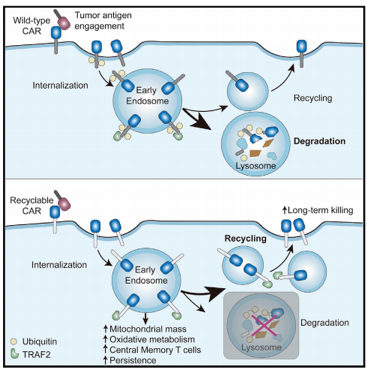 Immunity. doi:10.1016/j.immuni.2020.07.011
Immunity. doi:10.1016/j.immuni.2020.07.011
在該項研究中,研究人(rén)員首次證明(míng)了CAR受體(tǐ)在結合腫瘤抗原後會(huì)發生(shēng)泛素化修飾及溶酶體(tǐ)介導的CAR的降解,從而導緻細胞表面CAR受體(tǐ)水(shuǐ)平顯著 下調。研究人(rén)員進一步把CAR胞內(nèi)段的泛素化位點賴氨酸K突變為(wèi)精氨酸R(CARKR),阻斷了CAR的泛素化修飾及溶酶體(tǐ)的降解,抑制(zhì)了CAR的下調過程。改造後的CAR相較于傳統的CAR能夠賦予T細胞更強的抗腫瘤效果和(hé)持續活性。
機制(zhì)性探索發現,改造後的CAR在T細胞中循環(recycling),并在激活後富集在胞內(nèi)內(nèi)體(tǐ)(endosome)中,其胞內(nèi)段4-1BB結構域仍然結合着信号傳遞分子TRAF2,在胞內(nèi)執行(xíng)信号傳遞功能,因而增強了4-1BB下遊信号,促進了T細胞的代謝重編程(提高(gāo)線粒體(tǐ)的生(shēng)成及氧化磷酸化代謝)及中央型記憶T細胞的分化。研究團隊将這種全新的設計(jì)命名為(wèi)可(kě)循環CAR(Recyclable CAR)。這些(xiē)結果為(wèi)後續可(kě)循環CAR的臨床驗證提供了堅實的基礎。