
面對幹細胞治療的很(hěn)多(duō)不确定性,我們應當理(lǐ)性看待。盡管幹細胞藥物研發三期臨床試驗失敗累累,但(dàn)MSCs産品研發成果還(hái)是可(kě)圈可(kě)點。今天,我們就分析總結一下幹細胞治療成功的關鍵要素到底是什麽。
衆所周知,間(jiān)充質基質細胞 (Mesenchymal Stromal Cells, MSCs)或間(jiān)充質幹細胞(Mesenchymal Stem Cells, MSCs)治療是一種以調節炎症反應和(hé)參與組織修複再生(shēng)特性為(wèi)基礎的細胞治療。其機理(lǐ)也越來(lái)越清晰,MSCs的治療作(zuò)用主要歸因于其在炎症環境調控下發揮的免疫調節功能。在炎症因子刺激下,MSCs産生(shēng)大(dà)量免疫調節因子、細胞趨化因子和(hé)生(shēng)長因子,調節組織免疫微環境和(hé)內(nèi)源性成體(tǐ)幹細胞,促進組織修複。
MSCs第一次用于人(rén)類疾病治療開(kāi)始于1995年,從惡性血液病患者抽取骨髓并分離培養出貼壁的基質細胞,然後回輸到患者體(tǐ)內(nèi),觀察臨床效果并驗證其安全性。這是MSCs研究史上(shàng)的第一個(gè)裏程碑式的事件,标志(zhì)着MSCs的研究從實驗室跨入到臨床研究。
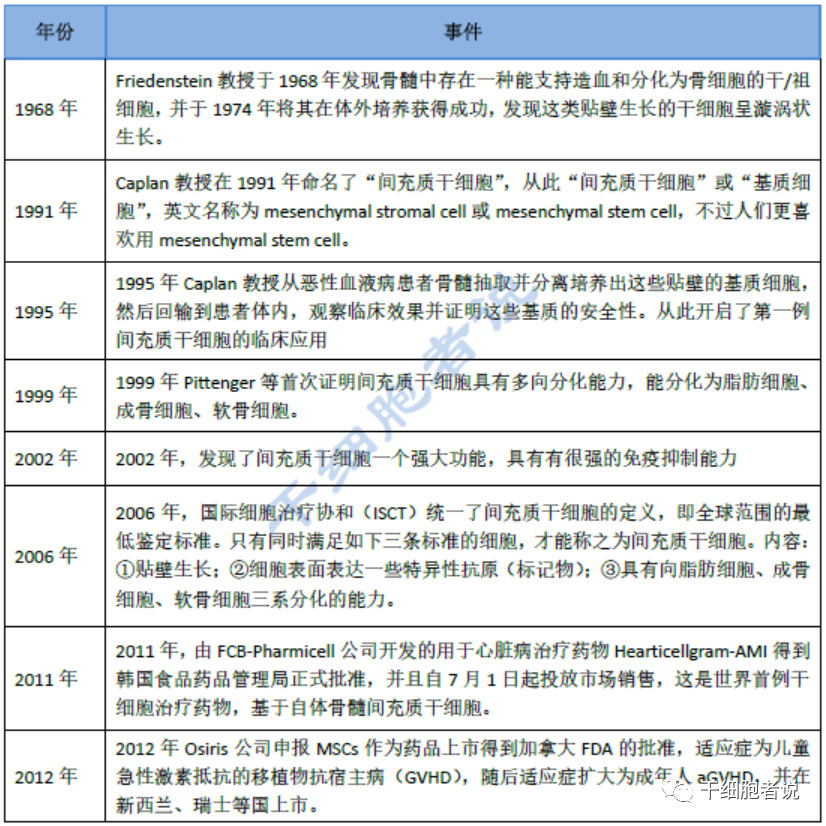 表1 MSCs研究發展曆程
表1 MSCs研究發展曆程
目前來(lái)看,MSCs已成為(wèi)全球開(kāi)展臨床研究項目數(shù)最多(duō)的細胞,非常非常的熱。然而迄今為(wèi)止,這些(xiē)細胞藥物在美國尚未擁有(yǒu)允許上(shàng)市許可(kě)的資格。全世界,特别是在美國,幾乎所有(yǒu)的三期MSCs藥物臨床試驗都是由藥企資助或主導的。針對幹細胞治療的未熟先熱,曾經有(yǒu)人(rén)批評這是一種幹細胞行(xíng)業的虛假繁榮。不僅僅中國存在幹細胞亂象,美國,日本諸國都存在,這是個(gè)世界級現象。很(hěn)多(duō)企業把未經證實的幹細胞治療(包括MSCs)作(zuò)為(wèi)“萬能神藥”進行(xíng)過分吹噓,宣稱包治百病。
那(nà)麽,幹細胞臨床治療是否有(yǒu)效?如何才能有(yǒu)效?該用什麽樣的細胞?用多(duō)少(shǎo)量的細胞最佳?
盡管幹細胞藥物研發三期臨床試驗失敗累累,但(dàn)MSCs産品研發成果還(hái)是可(kě)圈可(kě)點。Cell Stem Cell的一篇綜述道(dào)出了其中的大(dà)概緣由,以19項三期幹細胞臨床試驗(由藥企資助的)作(zuò)為(wèi)案例,分析總結幹細胞治療成功的關鍵要素。
本文主要通(tōng)過以下三個(gè)案例分析:異體(tǐ)骨髓來(lái)源MSCs治療移植物抗宿主病(GVHD)藥物,自體(tǐ)骨髓來(lái)源MSCs治療心髒衰竭(HF),以及異體(tǐ)脂肪來(lái)源MSCs治療克羅恩病并發肛周瘘口。
第一個(gè)觀點,我們以MSCs治療GVHD為(wèi)例。2012年,MSCs治療兒童抗移植物抗宿主病(GVHD)藥物(Prochymal)已經獲得(de)在加拿(ná)大(dà)和(hé)新西蘭的有(yǒu)條件上(shàng)市許可(kě)。随後,在日本也獲得(de)了批準(Temcell)。MSCs治療GVHD是藥企資助的第一個(gè)大(dà)型幹細胞臨床試驗(Prochymal)(NCT00366145),并且已經于2009年5月完成,細胞是志(zhì)願者捐贈的骨髓間(jiān)充質幹細胞(BMSCs)。然而結果顯示,在第一個(gè)有(yǒu)效評價點(即靜脈回輸後28天),相對于安慰劑組,幹細胞治療沒有(yǒu)明(míng)顯改善病症。
2013年,Prochymal産品從Osiris公司(美國)剝離給Mesoblast公司(澳大(dà)利亞)後。Mesoblast公司進行(xíng)的臨床試驗有(yǒu)四項,包括兒童GVHD(NCT02336230)、克羅恩病(NCT00482092)、慢性心衰(NCT02032004)和(hé)慢性腰背痛(NCT02412735)。研究者在分析最初Prochymal治療GVHD(NCT00366145)的數(shù)據發現,其總體(tǐ)的治療效果是無效,其研究對象并沒有(yǒu)針對性選擇兒童還(hái)是成人(rén)。
随後,研究者通(tōng)過大(dà)量在美國或歐洲的臨床試驗觀察到。在治療GVHD的臨床試驗過程中,兒童對異體(tǐ)MSCs治療反應性要優于成年人(rén);早期治療的患者治療效果要優于晚期治療;腸道(dào)和(hé)肝髒的GVHD反應靈敏要優于皮膚的GVHD。在沒有(yǒu)強有(yǒu)力可(kě)預測性生(shēng)物标志(zhì)物的情況下,這些(xiē)意見用于提供臨床試驗設計(jì),對适應症的選擇具有(yǒu)重要的指導意義。
接下來(lái)在臨床試驗(NCT02336230)的适應症設計(jì)中,采用了相同的MSCs産品和(hé)劑量方案,但(dàn)對患者選擇更有(yǒu)針對性,這些(xiē)因素包括年齡,疾病進程,以及排除隻有(yǒu)皮膚的GVHD,進行(xíng)幹細胞治療幹預,并且都是異體(tǐ)骨髓來(lái)源MSCs解凍後輸入。最重要的是,Mesoblast的這項臨床試驗研究對象是兒童,并且都使用凍存的細胞複蘇後注入。2017年12月,臨床試驗(NCT02336230)完成了所有(yǒu)患者招募。
2018年2月,Mesoblast就通(tōng)過媒體(tǐ)宣布,在治療後28天,發現幹細胞治療難治性兒童GVHD相對于傳統治療對照45%的反應性,取得(de)了顯著改善(69%的反應性)。意味着,這款藥物有(yǒu)望成為(wèi)在美國第一款獲得(de)FDA批準上(shàng)市的MSCs産品。
 表2.MSCs治療GVHD,兩項臨床試驗方案的對比
表2.MSCs治療GVHD,兩項臨床試驗方案的對比
最後補充一下,2019年5月,Mesoblast宣布已開(kāi)始向美國FDA提交其MSCs藥物Remestemcel-L (曾叫MSC-100-IV, 又叫Prochymal,授權日本銷售那(nà)個(gè)叫Temcell,其實都是一回事)的上(shàng)市申請(qǐng)(BLA),用于治療類固醇難治性aGVHD患兒。
對早期臨床試驗結果的合理(lǐ)判斷,會(huì)讓後期選擇參與臨床試驗的患者更能成功達到主要臨床評價點。正所謂,“失之毫厘,謬以千裏”。
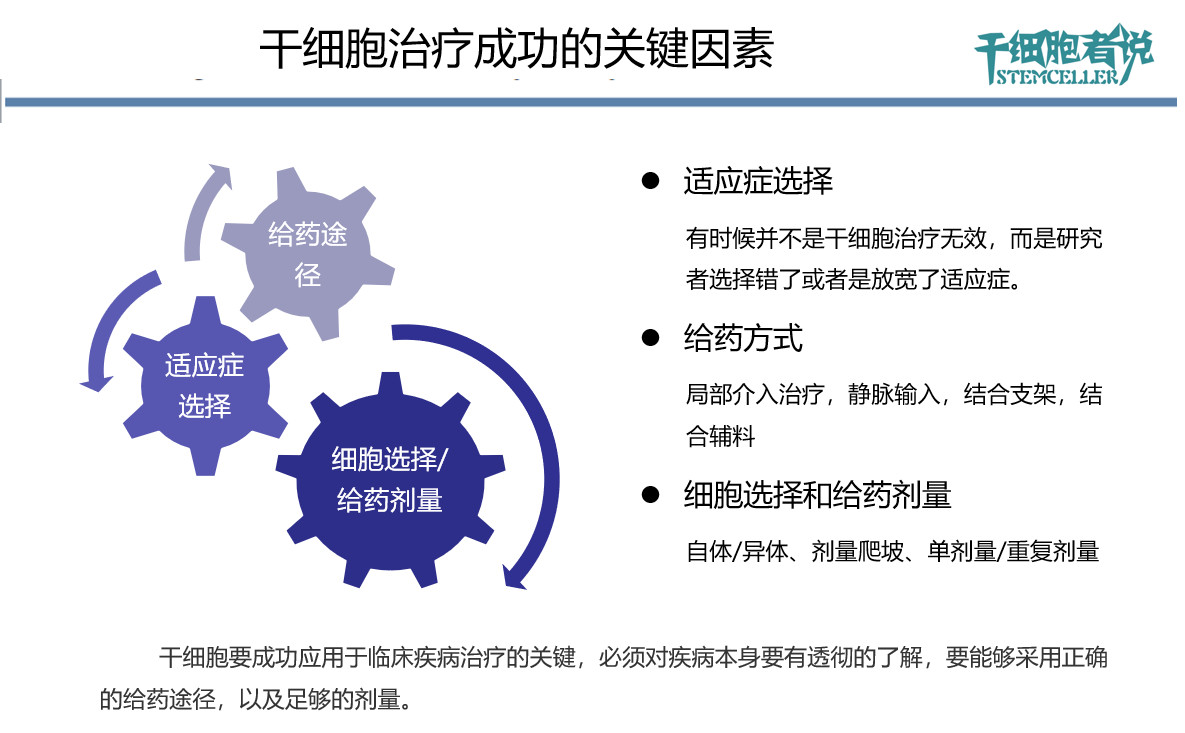
由此可(kě)見,有(yǒu)時(shí)候并不是幹細胞治療無效,而是研究者選擇錯了或者是放寬了适應症。
第二個(gè)觀點,我們再以MSCs治療心髒衰竭為(wèi)例。幹細胞三期臨床試驗(NCT01768702)是Celyad(比利時(shí))資助的一項自體(tǐ)骨髓間(jiān)充質幹細胞用于治療慢性缺血性晚期心髒衰竭的臨床試驗。采用的細胞同樣是骨髓間(jiān)充質幹細胞(BMSCs),與Prochymal産品的一個(gè)關鍵區(qū)别在于,Celyad對BMSCs進行(xíng)“心髒修複”方面的表型強化,并且不經過凍存環節,将6X10*8個(gè)細胞通(tōng)過介入的方法從心室将細胞直接給到病竈。
同樣是Celyad資助的臨床試驗(NCT00810238),其臨床結果表明(míng)使用了相同的MSCs産品可(kě)以改善心髒功能。然而,2016年的一項更為(wèi)充分有(yǒu)力的臨床試驗(NCT01768702)表明(míng)在MSCs組和(hé)安慰劑組在39周時(shí)并沒有(yǒu)顯著差異。與以往研究不同,這些(xiē)試驗利用了自體(tǐ)BMSCs,減輕了免疫排異,使其功能達到最佳狀态。但(dàn)是,後來(lái)發現給藥方式在該項治療中極為(wèi)關鍵。受試者接受6X10*8至12X10*8自體(tǐ)MSCs,重懸成10mL,分成18個(gè)位點注射,通(tōng)過心室每個(gè)位點注射0.5ml幹細胞,間(jiān)隔1cm注射。如何實現生(shēng)物學效應是技(jì)術(shù)上(shàng)一個(gè)重要挑戰。然而,該給藥方式的缺點是給藥方式技(jì)術(shù)難度大(dà)。對于低(dī)于8mm後的心室壁有(yǒu)穿孔的風險。
臨床試驗(NCT01768702)通(tōng)過心室給藥的受試者52周心肌重塑的結果顯示,最大(dà)改善組是接收中等數(shù)量的注射次數(shù)(即,<20)。而更高(gāo)的給藥次數(shù)反而導緻更糟糕的結果。有(yǒu)人(rén)擔心注射都集中在良好的心肌區(qū)域,可(kě)能會(huì)增加組織的破壞和(hé)惡化結果的風險。 這種觀察結果告訴我們,注射的次數(shù)可(kě)能是改善結果的一個(gè)重要因素,而過多(duō)的注射次數(shù)又可(kě)能導緻通(tōng)過多(duō)種機制(zhì),包括機械和(hé)生(shēng)物性心肌損傷。
由此可(kě)見,有(yǒu)時(shí)候并不是幹細胞治療無效,有(yǒu)可(kě)能是給藥方式的選擇出現了問題。不恰當的給藥方式可(kě)能會(huì)影(yǐng)響幹細胞治療效果。
第三個(gè)觀點,我們以MSCs治療肛周瘘口為(wèi)例。同Celyad選擇了自體(tǐ)骨髓MSCs一樣,Cellerix公司資助的一項臨床試驗(NCT00475410),選擇了自體(tǐ)脂肪間(jiān)充質基質細胞(也叫脂肪基質/幹細胞,adipose stromal cells,ASC)治療肛周瘘口,将患者自體(tǐ)高(gāo)達6000萬個(gè)脂肪幹細胞(加或不加纖維蛋白膠),在肛周瘘口多(duō)點局部注射,并用單獨的纖維蛋白膠作(zuò)為(wèi)空(kōng)白對照組比較。在2009年,總共214例受試者參與了該項研究,結果發現經脂肪幹細胞處理(lǐ)組6個(gè)月後瘘的愈合效果并沒有(yǒu)優于單獨纖維蛋白膠組。
2011年5月,Cellerix被TiGenix公司收購,啓動Cx601細胞藥物三期臨床試驗(NCT01541579)。TiGenix公司就是比利時(shí)那(nà)個(gè)開(kāi)發了細胞藥物ChondroCelect(自體(tǐ)軟骨細胞移植(ACI)),并且成功在歐洲上(shàng)市的公司。适應症是:膝骨關節炎。根據NCT00475410獲得(de)的臨床數(shù)據,由TiGenix贊助的三期臨床試驗将治療方案做(zuò)了如下改動:
1. 采用異體(tǐ)脂肪幹細胞,而非自體(tǐ)脂肪幹細胞
2. 細胞劑量從0.6億增加至1.2億個(gè)細胞,
3. 不再采用纖維蛋白膠基質膠做(zuò)腔內(nèi)注射;
4. 僅納入克羅恩病患者(之前在試驗NCT00475410中被排除)。
TiGenix贊助的臨床試驗(NCT01541579)在2015年已完成,也意味着MSCs/ASC在高(gāo)級臨床試驗應用的成功。相關臨床研究結果發表在2016年《The Lancet》,表明(míng)異體(tǐ)脂肪幹細胞治療是顯著優于安慰劑。與安慰劑相比,24周後幹細胞治療組緩解率高(gāo)于安慰劑(50%對34%)。治療後,這些(xiē)正向結果持續了至少(shǎo)1年。
 表3.MSCs治療肛周瘘口,兩個(gè)臨床試驗方案的對比
表3.MSCs治療肛周瘘口,兩個(gè)臨床試驗方案的對比
與先前的失敗的臨床試驗不同,此次臨床試驗有(yǒu)三個(gè)很(hěn)有(yǒu)意義的因素:合适的幹細胞,給藥途徑和(hé)給藥劑量。
其一,臨床試驗采用是正在培養中的細胞,而非解凍後直接注射。其二,采用1.2億個(gè)細胞重懸24ml,直接病竈內(nèi)注射,而非通(tōng)過靜脈回輸的方式。最後,采用的是細胞庫中同種異體(tǐ)來(lái)源的脂肪幹細胞,而非自體(tǐ)脂肪幹細胞。固然,節省成本是一回事。但(dàn)這也使得(de)臨床前的動物模型試驗更好摸索到合适的給藥劑量,從而使MSCs産品發揮最大(dà)限度的生(shēng)物學功能。
在2018年3月的時(shí)候,歐盟批準幹細胞藥物Alofisel(也就是Cx601),用于瘘管對至少(shǎo)一種傳統或生(shēng)物療法反應不足的非活動性/輕度活動性管內(nèi)克羅恩病(CD)成人(rén)患者複雜性肛周瘘口(CPF)的治療。從而,Alofisel成為(wèi)歐洲市場(chǎng)首個(gè)獲得(de)集中上(shàng)市許可(kě)(MA)批準的異體(tǐ)幹細胞療法。
由此可(kě)見,有(yǒu)時(shí)候并不是幹細胞治療無效,有(yǒu)可(kě)能是細胞的選擇或是給藥劑量出現了問題。這同樣會(huì)影(yǐng)響幹細胞治療效果。
這19項藥企資助或主導的三期臨床試驗适應症包括:抗移植物宿主病、心髒衰竭、克羅恩病并發肛周瘘口、關節損傷、慢性脊髓損傷等。如果按組織來(lái)源分:14項是骨髓間(jiān)充質幹細胞(BMSCs),3項是脂肪間(jiān)充質幹細胞(ASC),2項是臍帶間(jiān)充質幹細胞(UCMSC)。如果按照其細胞來(lái)源:11項是同種異體(tǐ)細胞治療,8項是自體(tǐ)細胞治療。如果按照給藥方式:靜脈回輸、局部注射、與支架混合、局部介入治療。
知其然,知其所以然。幹細胞不是萬能神藥,幹細胞治療的有(yǒu)效性是建立在對幹細胞和(hé)疾病正确認識的基礎之上(shàng)!幹細胞藥物開(kāi)發和(hé)臨床研究是一項空(kōng)前複雜的系統工程,涉及到多(duō)學科、多(duō)技(jì)術(shù)、多(duō)因素綜合考慮。其所面臨的問題不單純是細胞學家(jiā)和(hé)醫(yī)生(shēng)就能夠考慮周詳的。關山(shān)難越,任重道(dào)遠。我們既不要過早的宣布勝利,也不要過早的放棄一個(gè)有(yǒu)希望的治療策略。
最後,我們以一張PPT總結本文:
 參考內(nèi)容:
[1]Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell 22, 824–833 (2018)
參考內(nèi)容:
[1]Mesenchymal stromal cells: Clinical challenges and therapeutic opportunities. Cell Stem Cell 22, 824–833 (2018)